В споре рождается истина… о коррозии
- 25 Dec 2024
- Производство, промышленность
- 261 Прочтений
- 0 Комментариев
Цивилизация и коррозия – кто кого?
Чтобы бороться с окалиной и ржавчиной на металле, нужно знать, как они образуются.
Нелегко было ученым древности определить причину разрушения металлов. Тысячелетия люди считали металл аморфным, не имеющим определенной кристаллической структуры. Воздух представлялся им состоящим из однородного эфира. Никто еще не занимался изучением особенностей воды и растворенных в ней солей и кислот. Однако в наблюдательности древним отказать нельзя. То, что мы сегодня называем результатом коррозии, было ими замечено и описано. Хорошо отражает отношение многих поколений к коррозии полная горечи фраза Плиния Старшего, утверждавшего, что ржавление проклятием ложится на железо.
В свое время Ломоносов высказал мысль, что при прокаливании металлы соединяются с воздухом, образуя окалину. Так появилась первая научная теория окисления металлов — теория химической коррозии. В то время состав воздуха еще не был известен, поэтому ученый не мог назвать главного виновника появления окалины. Позднее Лавуазье доказал, что металлы окисляются, соединяясь с кислородом.
Особенности, отличающие металлы от других веществ, натолкнули Ломоносова на мысль о взаимосвязи химических и электрических явлений при растворении металлов. Он высказал предположение, что металлы в кислых спиртах растворяются иначе, чем соли в воде. Догадка подтвердилась. Наблюдая за растворением цинка в кислотах, де ля Рив предложил рассматривать такие разрушения металла как результат действия гальванических элементов. Эта первая теория электрохимической коррозии металла послужила основой многих научных работ.
Здесь мы остановимся и выясним, откуда произошло название «гальванический элемент».
Исследуя влияние атмосферного электричества на сокращение мышц препарированных лягушек, биолог Гальвани подвешивал их на железную проволоку при помощи медных стержней, введенных в спинной мозг. Он заметил, что когда ветер раскачивал лягушек и они касались лапками железной проволоки, наблюдалось сокращение мышц. Так был создан «гальванический» элемент. Он состоял из двух разных металлов — железа и меди, соприкасающихся с раствором — жидкостью, содержащейся в животной ткани.
Физик Вольта оценил незначительное на первый взгляд явление из далекой от физики области (подумаешь, дергались лапки у лягушек!) и в 1799 году создал первый электрохимический коррозионный элемент — химический источник тока. Он состоял из чередующихся медных и цинковых кружков, попарно соприкасающихся друг с другом и разделенных суконными прокладками, смоченными кислотой.
Жизнь требовала объяснения процессов, происходящих в гальваническом элементе. Была создана химическая теория, которая определяла «механику» и «химию» реакций на границе «металл-раствор». Ее авторы — Риттер, Нерист и Оствальд. Часть ее — знаменитые уравнения Нериста, получившие в наше время строго научное термодинамическое обоснование, — вошла во все современные книги по теоретической электрохимии и теории коррозии.
Колоссальным шагом вперед для науки о разрушении металла была теория двойного электрического слоя на границе «металл-раствор», разработанная Гельмгольцем, который предложил переходный слой между металлом и раствором считать похожим на обычный плоский конденсатор. Формулы для расчета были понятны и ни у кого не вызывали сомнений. Стоило лишь подставить в них вместо толщины диэлектрического слоя между обкладками толщину двойного слоя, равную радиусу иона, равенство зарядов на обкладках конденсатора соотнести с равенством зарядов на поверхности металла и со стороны раствора — и можно выполнять нужные вычисления. Для растворов со слабыми концентрациями солей все получалось великолепно: расчеты не отличались особой сложностью, результаты оказались удовлетворительными, ученые были довольны.
Но упрощение — коварная вещь! Оно дает хорошие результаты для узкого диапазона изменения условий. Стоит выйти за его пределы — и все нарушается. Хотите проверить? Нарисуйте от руки окружность радиусом 3-4 миллиметра. Получается вполне сносно. Теперь (без всяких приспособлений) — окружность радиусом 3-4 сантиметра. Все огрехи ручной работы сразу станут явными. Примерно так же получилось, когда проверяли теорию Гельмгольца в растворах с большой концентрацией солей: разница между расчетными и экспериментальными данными обусловливала слишком большую погрешность.
Пытаясь устранить недостатки теории Гельмгольца и связать плотность зарядов в двойном слое с составом раствора, Гуи отказался от строгого закрепления зарядов на обеих сторонах электрического слоя и «разрешил» этим частицам двигаться под действием теплового молекулярного движения. Получалась довольно сложная картина, но зато она давала лучшее объяснение, когда теория Гельмгольца не подходила.
Попытку объединить обе теории предпринял Штерн. В отличие от своих предшественников он «весь груз ответственности» перенес на кристаллическую решетку металлов. Так родилась адсорбционная теория двойного электрического слоя. Не удивительно, что в Америке, куда эмигрировал Штерн, спасаясь от преследований нацистов, ему была присуждена Нобелевская премия именно за исследования атомной структуры металлов. Впоследствии его теорию усовершенствовали.
Конечно, эта теория могла и не появиться на свет или родиться значительно позднее, если бы в 1878 году русский ученый Д. К. Чернов не установил, что при застывании сталь образует сложную систему кристаллов (кристаллическую структуру имеют, кстати, все 70 металлов, известных сегодня науке).
Ученые и дети похожи друг на друга: и тем и другим надо знать, как устроен мир. А потому им нужно «разобрать» его на части, посмотреть, что и как. В детстве просто: расковырял папиной отверткой мамину пудреницу — и все ясно. Ученым приходится ставить массу экспериментов, чтобы разобраться в различных явлениях, следить, чтобы между теорией и практикой не было «разногласий», отвечать на каверзные вопросы, которыми занимается наука...
И создаются новые теории. Одна из них — теория необратимых потенциалов, возникающих на металле, разработанная А. Н. Фрумкиным и Г. В. Акимовым в 1932 году. Понадобилось еще 14 лет уточнений и дополнений, пока в 1946 году Я. М. Колотыркин не обнаружил новую особенность — на одном и том же участке металлической поверхности процессы разрушения вспыхивают и гаснут, как вулкан или гейзер, подчиняясь невидимым силам.
...Прервем изложение. Обратите внимание на этих и упоминавшихся ранее ученых, на тех, о ком речь еще впереди. Каждый внес свой вклад в мировую науку. Пусть достижения некоторых из них и не связаны непосредственно с коррозией, но тем не менее с их помощью защита металлов и строительных материалов достигла сегодня высокого уровня...
Развитие электрохимической теории коррозии (а сейчас все больше коррозионных явлений ученые пытаются объяснить именно с ее помощью) было бы невозможно без успехов в изучении свойств растворов, в которых происходят коррозионные разрушения. Почему раствор поваренной соли проводит электрический ток, а спирт нет? В 1887 году Аррениус сформулировал теорию электролитической диссоциации растворов, сыгравшую важную роль во всех исследованиях, связанных с водной средой. Почти 50 лет эта теория была основой различных электрохимических расчетов, пока Дебай и Гюккель не выдвинули новую, которая «позволяла» ионам располагаться в растворе только в виде сфер. Центром каждой из них был ион.
Как полноводная река, теория коррозии вобрала в себя большие и малые притоки многих открытий и гипотез. Конечно, они перечислены далеко не полностью. Но даже то, что нашло здесь место, дает представление о нелегком пути ее развития. Впрочем, в этом она нисколько не отличается от других наук.
Интересную мысль высказал на эту тему Вант-Гофф. Суть ее в следующем.
Ход развития какой-либо науки состоит из двух различных периодов: сначала все научные исследования имеют описательный характер или характер систематики; затем они приобретают рациональный или философский характер...
Во время первого периода научные исследования ограничиваются накоплением и согласованием материалов, составляющих основу данной науки.
Во втором периоде развития исследования уже не ограничиваются накоплением и согласованием материалов, но переходят к причинной связи...
История всякой науки заключается в эволюции от описательного периода к периоду рациональному.
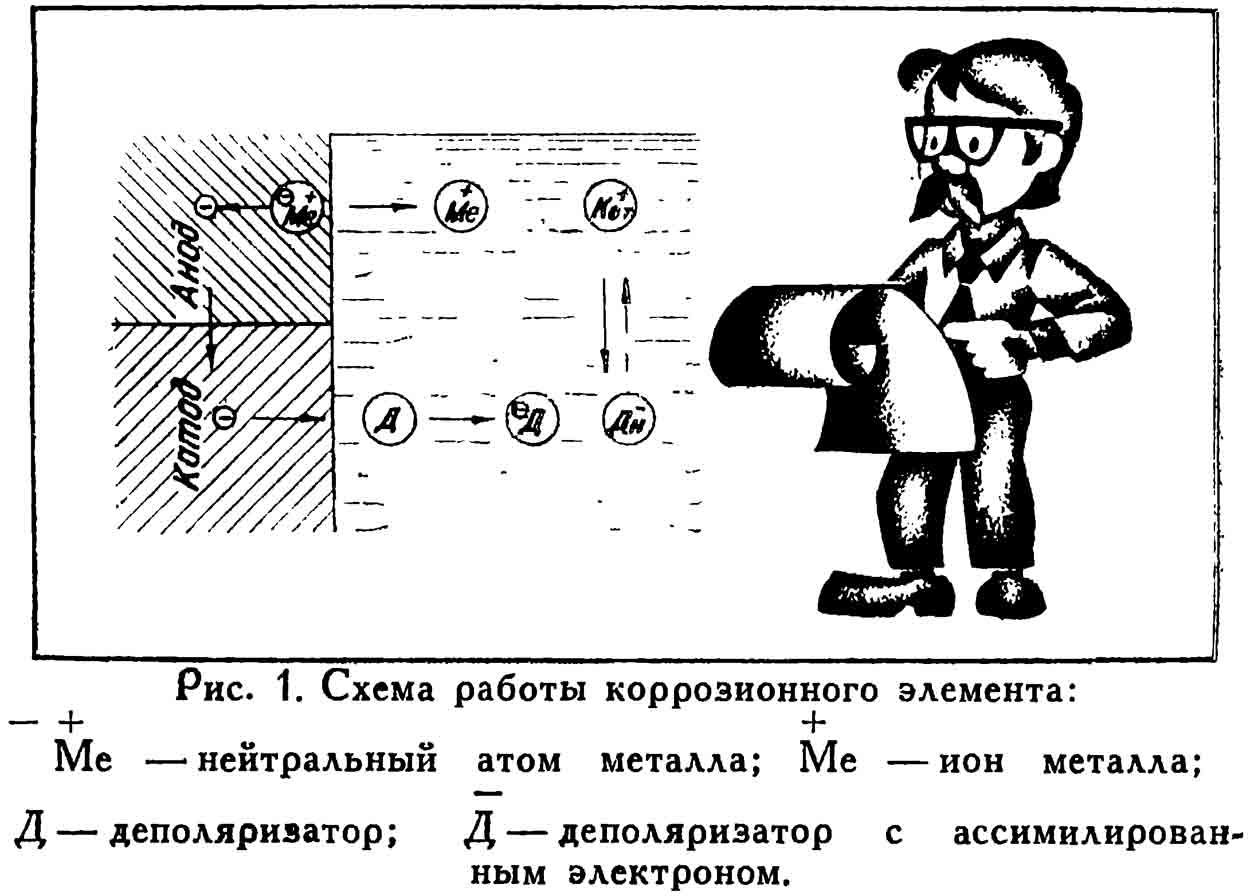
Теория коррозии металлов окончательно сформировалась уже в наше время. Конечно, революционные взрывы не исключены и здесь. Как бы там ни было, в простейшем виде коррозионный процесс сегодня выглядит так: при соприкосновении с электролитом на поверхности металла возникают коррозионные элементы. По своей природе они сродни элементам Гальвани. Причина их возникновения — в различных внутренних (состав и кристаллическое строение металла, чистота обработки поверхности) и внешних (концентрация и температура электролита, доступ воздуха) факторов. Если, например, в море опустить вертикально вниз стальную трубу так, чтобы один ее конец уткнулся в грунт, а другой выглядывал из воды, то на ней можно было бы отметить границы потенциальных зон: в грунте, в местах подводных течений, в поверхностном слое воды, богатой кислородом, и так далее. Предположим теперь, что мы подключили электрический прибор к границам соседних зон на нашей воображаемой трубе. Мы заметили бы некоторую разность потенциалов. Кстати, подключив тот же прибор к ее противоположным концам, мы, возможно, не обнаружили бы электрический ток. Не будем, однако, спешить с выводами — вероятно, токи гальванических элементов разной полярности компенсируют друг друга.
Коррозионный элемент можно представить в виде двух участков металла с различными потенциалами, соединенных между собой массой металла как проводником и погруженных в общий электролит. Образуется электрическая цепь, в которой течет ток от участка с большим потенциалом к электролиту, а затем от электролита — к участку с меньшим потенциалом. На анодных участках металл разрушается из-за перехода его ионов в электролит. В это время на катоде накапливаются избыточные электроны. Они попадают в ловушку какого-нибудь нейтрализатора — водорода или кислорода. Вот почему именно с отсутствием кислорода связывают свои надежды те, кто в глубинах Карибского моря продолжает искать остатки каравеллы Колумба. Ведь если будет заторможен катодный процесс, то и в анодных зонах должны значительно уменьшиться разрушения. Анодный и катодный процессы протекают параллельно, их разделяет только пространство (и то, как доказал Я. М. Колотыркин, не всегда!). Схема этого процесса показана на рис. 1.
Этот абзац может показаться скучным, но его нельзя было опустить: он разъясняет суть коррозии — явления такого же «первобытного», как огонь, дождь, испарение.
Коррозия металла в трещинах и зазорах, контактная коррозия двух разных металлов, коррозия металла под одновременным воздействием электролита и механического напряжения, коррозия при трении и многие другие ее разновидности имеют, конечно, свои особенности. Но в целом этот процесс подчиняется одним и тем же закономерностям.
А теперь ответим на вопрос: всегда ли сталь покрывается пленкой окислов, если ее опустить в раствор кислоты или соли? Ответ ясен: да. А всегда ли эта пленка — сигнал опасности разрушения металла?
На второй вопрос одним словом не ответишь. Здесь мы сталкиваемся с очень интересной и важной для практики особенностью некоторых металлов, которая называется пассивностью.
Типичный пример пассивности металлов: скорость растворения железа в растворах азотной кислоты уменьшается при увеличении ее концентрации. Наблюдавший это явление Ломоносов заметил, что при употреблении достаточно крепкого селитряного спирта для растворения металлов растворение быстро кончается, так как растворитель перестает действовать. Почему?
Пленочная теория пассивности недавно отметила свой столетний юбилей: в 1876 году Фарадей высказал предположение, что пассивное состояние вызвано присутствием на поверхности металлов химически связанного кислорода. Это дало толчок научной мысли. В наше время существует несколько теорий пассивности, построенных на разных представлениях о пленке (кстати, Эвансу удалось отделить пленку от металла, сделать ее видимой). Их авторы — советские ученые В. А. Кистяковский, Н. А. Изгарышев, Г. В. Акимов, Я. М. Колотыркин, английский ученый Эванс. Одна теория доказывала, что пассивная пленка на металле обязательно связана с изменениями состава и структуры его поверхностного слоя, другая — что пленки не остаются неизменными, а находятся в динамическом равновесии, как вода под слоем льда, третья обусловливала адсорбционно-электрохимический механизм пассивности.
Какую бы из теорий мы ни считали справедливой, ясно одно: наступление пассивности должно быть связано с уменьшением скорости анодной реакции, а значит, с уменьшением разрушения металла.
Изучение болезней металлов — не самоцель. Главное — поиск способа лечения или предупреждения заболевания. Там, где можно не допускать соприкосновения поверхности металла с раствором, именно этого и добиваются. Ну, а если это невозможно? Тогда пробуют вышибить клин клином. Используя научную терминологию, можно сказать иначе: применяют защиту от электрохимической коррозии на основе электрохимических явлений.
Принцип электрохимической защиты основан на различной химической активности металлов, то есть на различной способности вступать во взаимодействие с другими химическими веществами. Применение активного металла для защиты менее активного предложил Деви в 1824 году. Он в то время занимался проблемой надежности кораблей. Можно смело сказать, что его предложению было суждено «большое плавание». Впрочем, идея, как говорится, витала в воздухе. Специальной обработкой железных гвоздей, в результате которой на их поверхности образовывалась окисная пленка, С. П. Власову удалось в 1820 году снизить скорость разрушения медной обшивки кораблей. Б. С. Якоби, исследуя коррозию микрогальванических элементов на стальных корпусах мин, предложил в 1856 году защищать их пластинками из цинка — более активного металла, чем сталь.
Но систематизация свойств металлов, на основе которой можно делать важные практические выводы, была предложена позднее Н. Н. Бекетовым. Он открыл ряд, называемый теперь электрохимическим рядом напряжений металлов: Са, Na, Mg, Al, Zn, Cr, Fe, Pb, H, Cu, Hg, Ag, Pt, Au.
Замечательное свойство этого ряда заключается в том, что каждый металл, стоящий левее, может вытеснить все следующие за ним металлы из растворов солей (теперь становится понятным, почему на яхте «Штандарт» разрушились железные, а не медные части).
Устройствами электрохимической защиты оборудуют корабли, стальные конструкции в портах, подземные и подводные сооружения (рис. 2). Добавим к этому, что она получила «постоянную прописку» во всех странах обоих полушарий. Только в Японии расходы на все виды этой защиты в 1976 году превысили 15 миллиардов иен, а затраты на научные исследования коррозии и антикоррозионной защиты в 1975 году достигли 22 миллиардов иен.
Рис. 2. Электрохимическая защита подземной трубы: а — распределение коррозионных гальванических элементов по поверхности трубы; б — коррозионный гальванический элемент; в — защита с помощью протектора; г — трехэлектродная система, которой пользуются при защите с помощью протектора.
На первых порах, анализируя возможности применения электрохимической защиты, ученые ориентировались на величину плотности тока — ее легко измерить и отрегулировать. За определение защитной плотности тока взялись Харкер и Номарра. Они создали отвергнутую теперь теорию «обратного электролиза»: для защиты от коррозии нужен точно такой же ток, который разрушает металл. Это мнение разделяли многие исследователи, пока Томсон и Хильдебранд не доказали, что в подобных случаях обеспечивается лишь частичная защита — не более 70 процентов.
Это вызвало новый поток гипотез. Уже известный нам Эванс пытался объяснить процесс электрохимической защиты металла образованием щелочного раствора у поверхности. Но почему же тогда разрушаются металлы в концентрированных щелочах?
Современная теория и практическое использование электрохимической защиты связаны с именами Г. В. Акимова и Н. Д. Томашова. Советские ученые доказали, что защитный ток зависит от скорости коррозии, а скорость коррозии, в свою очередь, — от соотношения анодных (разрушающихся) и катодных (неразрушающихся) микроучастков поверхности. Если преобладают анодные участки, защитный ток должен превышать ток коррозии, если катодные — защитный ток приближается к току коррозии, а в тех редких случаях, когда состояние металла определяют одни катодные участки, ток защиты равен току коррозии.
Не нами придумано сравнение разрушающейся конструкции с больным. Если воспользоваться этой аналогией, то анодные участки можно сравнить с пораженнойожогом кожей, катодные — со здоровой, ток защиты — с кислородом, который может спасти больного. Чем больше площадь ожогов, тем больше нужно кислорода, чтобы восполнить дыхательную работу кожного покрова. По мере выздоровления количество кислорода уменьшают до обычной нормы.
Даже после всемирного признания электрохимической защиты приходилось сталкиваться с непредвиденными осложнениями. Одно из них связано с расширением сети подземных и подводных сооружений, затрудняющих необходимые измерения, без которых нельзя контролировать качество защиты. Так возникла проблема расчета защитного потенциала. Формула Нернста (вспомните — мы о ней уже говорили) как будто открывала прямую дорогу к решению этого вопроса, но точность этого решения зависела от точности определения скорости коррозии. Этой частной, но очень важной задачей занимались многие советские и зарубежные ученые. Свой вклад внес и наш украинский академик И. Н. Францевич. Кстати, школа коррозионистов, созданная им в Киеве, — одна из ведущих в СССР.
Таков путь коррозионной науки в самом сжатом изложении. Она и сегодня продолжает развиваться — этого требуют многие отрасли народного хозяйства. О том, как защищают от коррозии различные объекты — от швейных иголок до кораблей, — расскажут другие разделы этой книги.
В.П. Фишман, 1981 год






Letzte Kommentare
Artikel
Fotos
Eigene Seiten